하등척추동물 종양연구모델 소개
강원대학교 수의과대학
김상화 (sangwhakim@kangwon.ac.kr)
소개
암은 현대 의생명과학계에서 가장 중요하게 다뤄지고
있는 화두 중 하나입니다.1 학계에서는
면역관문억제제, 종양 백신, 순환종양세포 등 다양한 주제를
필두로 암의 발생 억제, 치료, 전이 억제, 재발 억제에 대한 다양한 첨단 연구를 수행해오고 있습니다.
학계에서
가장 많이 사용되어 온 종양연구 실험동물종은 단연 마우스와 랫트입니다. 그러나 이들 외에도 다양한 생물종들이
종양연구의 모델동물로 이용되면서 다면적으로 활용되고 있어 연구자들에게 더 넓은 선택지가 주어지고 있습니다(그림 1).
하등동물종을 연구에 활용하려는 노력의 저변에는 1) 유전자 변이주
확보의 용이성, 2) 측정 및 분석효율 고도화, 3) 특정
종이 지니는 해부학적/기능적 특성 활용, 4) 동물실험윤리에
따른 3R 재고, 네 가지의 이점이 깔려있습니다.

그림 1. 연구 목적 및 질문에 따른 적합한 모델동물종 선택
(AI-generaged image; www.canva.com)
종양아바타모델 제브라피시 활용
선천/후천면역이 조화를 이루고 있는 인간과 유사한 형태의 면역체계를
처음 갖추기 시작하는 하등동물은 어류이므로, 모델생물로써의 활용도는 다양한 하등동물종 중 어류에서부터
유의하게 높아집니다. 그 중 제브라피시는 유전자 변이주 확립이 매우 용이하고 빠르게 수행될 수 있는
대표적인 동물종 중 하나로, 수많은 라인이 기 확립되어 있어 연구에 수월하게 이용될 수 있습니다.2,3
제브라피시만의 이점을 가장 잘 살린 연구 중 하나가 바로 환자의 종양 아바타모델 확립 연구입니다. 제브라피시는 성장이 빠르고 번식 속도가 매우 빠르며 그 크기가 작아 high-throughput으로
약물에 대한 반응 확인을 수행할 수 있는데, 이 이점들을 모두 활용하여 환자 개인의 종양 아바타 모델을
만들고, 해당 환자에게 적합한 약물을 빠르게 스크리닝하는 방식에 대한 연구가 최근 수행되었습니다.4 제브라피시 환자 유래 이종이식 모델은 GFP등으로 표지된 암세포를 수정 후 48시간 된 유생이나 유전적으로 면역 결핍된 성체 제브라피시(prkdc−/−;il2rga−/−, temperature acclimated)에 이식함으로써 만들 수 있습니다(그림 2). 이렇게 확립된 아바타 모델은 약물활용 최적화에 이용되어 환자 개인 맞춤의학 툴로 사용될 수 있을 뿐 아니라 약물 repurposing, 신종 약물 발굴등을 high-throughput 연구의 플랫폼으로 활용될 수 있습니다.
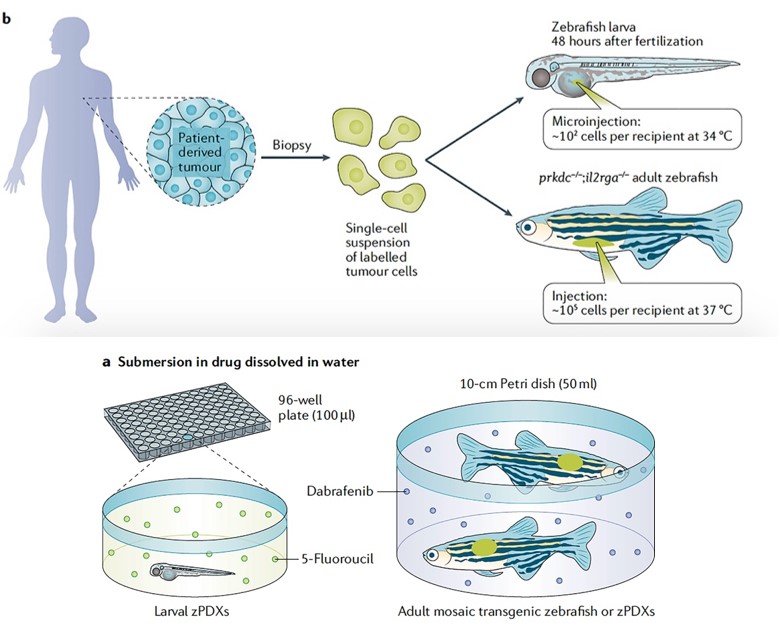
그림 2. 제브라피시 종양아바타모델 확립 방식(위) 및
제브라피시 아바타모델을 활용한 high-throughput 약물활용 최적화(아래)
종양타겟팅항체 IgNAR 상어 활용
상어는 지구상에서 가장 원시적인 형태의 MHC & RAG 기반
후천면역시스템을 갖추고 있습니다. 이에 원시적 형태의 면역 글로
불린인 상어의 IgNAR가 종양타겟팅 혹은 종양백신연구에까지 활용되고 있습니다.5 IgNAR는 heavy chain과 light chain으로
이루어진 일반 면역글로불린과 달리 heavy chain만으로 이루어져있으며 그 분자량이 매우 작아 조직
및 세포 내 침투력, 온도 안정성 등이 월등히 좋습니다. 이에
특정 암 표적에 대해 더욱 특이적으로 결합할 수 있는 잠재력을 가지고 있어, 이를 활용하고자 하는 연구진들에
의해 모델동물로 nurse shark (Ginglymostoma cirratum),
wobbegong shark (Orectolobus ornatus), horn shark (Heterodontus
francisci)와 같은 상어종들을 이용할 수 있습니다(그림 3).
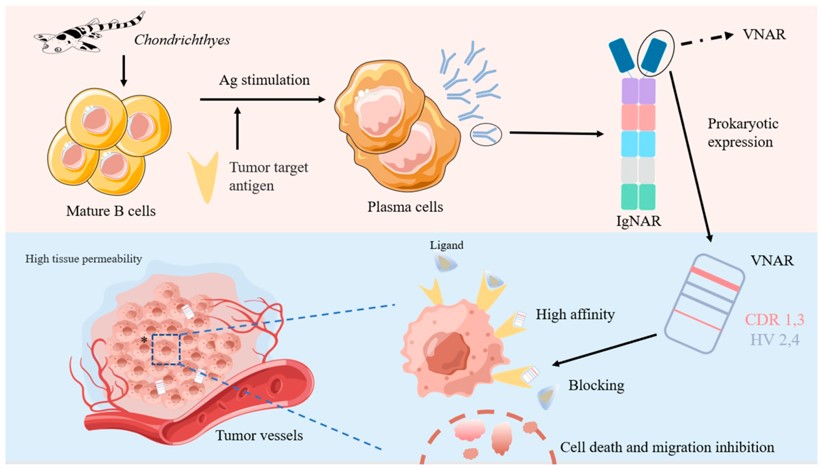
그림 3. 상어 IgNAR를 활용한 종양타겟팅
종양발생저해 및 치료 메커니즘 외삽을 위한 야생동물종 활용
특정 종이 지니고 있는 종양 발생 및 저해 메커니즘에 대하여 해부학적/기능적
특성을 발굴하고 활용하는 형태의 연구들 또한 다수 수행되고 있습니다. 이는 필연적으로 다양한 야생동물종에
대한 기초생물학 연구와 직접적으로 결부되어있습니다. 종양 발생율이 유의하게 높거나 낮은 동물종(킬리피시, 페릿 등) 또는
종양 발생율이 유의하게 낮은 동물종(벌거숭이두더지쥐, 코끼리, 고래 등) 등 다양한 종이 연구모델동물로 활용되어 이들의 종양저해
메커니즘을 발굴하거나 새로이 확립하는 연구에 이용되고 있습니다.6
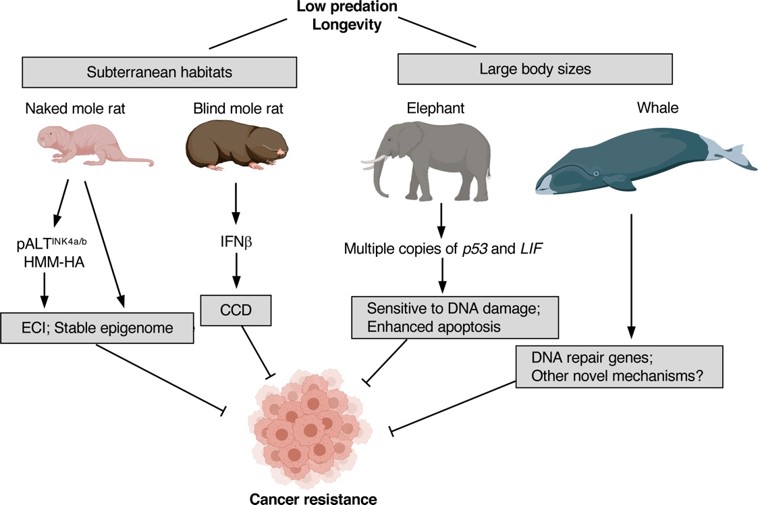
그림 4. 야생동물종을 모델동물로 활용한 종양발생저해 메커니즘 연구
그 중 대표적으로 벌거숭이두더지쥐(naked molerat)의 경우 30년의 긴 수명을 가지면서도 종양 발생률이 유의하게 낮으며, 동시에
작은 체구를 가지고 있어 종양 저항성 메커니즘 연구에 활발히 활용되고 있습니다(그림5).7 이들은
유전체 안정성, 단백질 안정성, 산화 스트레스 메커니즘 등을 종양 저항 원리로 갖추고 있어 관련 연구에 활발히 이용되고 있습니다.
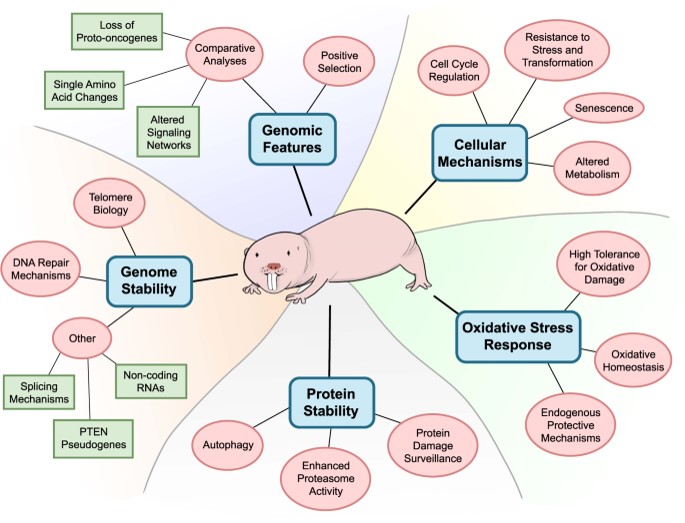
그림 5. 벌거숭이두더지쥐(naked mole rat)의 종양 저항성 메커니즘
맺음말 및 향후 전망
암 연구의 발전에 있어서 다양한 동물 모델의 활용은 중요한 역할을 합니다. 특히, 제브라피시와 같은 어류와 기타 하등척추동물을 이용한 연구는 암 발생 및 치료 메커니즘의 이해를 한층 깊게 하며, 이러한 모델들은 병리학적 연구 뿐만 아니라 치료제의 발견과 개발에서도 중요한 자리를 차지할 것으로 기대됩니다. 상어 IgNAR 항체와 같은 특이적 접근법은 종양 타겟팅에 새로운 차원을 제시하고, 벌거숭이두더지쥐와 같은 특수 모델을 이용한 연구는 암의 내재적 저항성 메커니즘에 대한 깊은 통찰을 제공합니다. 앞으로 이러한 연구들은 마우스나 영장류와 같은 고등척추동물에서의 연구결과와 결합하여, 암의 예방과 치료를 위한 새로운 전략과 치료법 개발로 이어질 것입니다. 끝으로, 이러한 연구들은 결국 인간에게 적용되어 암을 극복하는 데 필수적인 기여를 할 것으로 전망됩니다.
- CDC, National Center for Health Statistics. Deaths and Mortality, 2019
- Berghmans et al., "tp53 mutant zebrafish develop malignant peripheral nerve sheath tumors," Proceedings of the National Academy of Sciences, 2005
- Langenau et al., "Myc-induced T cell leukemia in transgenic zebrafish," Science, 2003
- Fazio, M., Ablain, J., Chuan, Y. et al. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nat Rev Cancer 20, 263–273 (2020)
- Wei Shien Cheong et al. Diagnostic and therapeutic potential of shark variable new antigen receptor (VNAR) single domain antibody. International Journal of Biological Macromolecules. (2020) 147, 369-375
- Zhao et al. Revelations about aging and disease from unconventional vertebrate model organisms. Annual Review of Genetics. (2021) 55, 135-159
- Shepard, A., Kissil, J.L. The use of non-traditional models in the study of cancer resistance—the case of the naked mole rat. Oncogene 39, 5083–5097 (2020)
