- N-데그론 경로 이용한 PROTAC 물질 최초 개발
- 세포 종류 관계없이 원하는 단백질 분해


(왼쪽) 이영주 박사 (포항공과대학교 화학과), lyj0308@postech.ac.kr
(오른쪽) 임현석 교수 (포항공과대학교 화학과), hslim@postech.ac.kr
□ 포스텍(포항공과대학교) 화학과 임현석 교수와 이영주 박사 연구팀이 고려대 송현규 교수와 서울대 안지완 교수, KIST 이준석 박사와 공동 연구를 통해 암 세포 안의 표적 단백질만 골라 효율적으로 분해할 수 있는 단백질 분해제 개발에 성공했다.
□ 이 연구결과는 화학분야 권위지인 독일화학회지 ‘앙게반테 케미(Angewandte Chemie)’ 7월 호에 게재됐으며, 10% 미만의 논문에만 주어지는 ‘주목받는 논문’으로도 선정됐다.
(논문명 : Targeted Degradation of Transcription Coactivator SRC-1 through the N-Degron Pathway. 2020, 59,17548-17555)
□ 암의 표적 단백질을 추적해 분해함으로써 암의 발생과 전이를 억제할 수 있는 새로운 작동경로를 최초로 규명했다고 설명했다.
□ N-말단 분해 경로(N-degron pathway)는 단백질의 N-말단에 위치하는 잔기(residue)가 그 종류나 상태에 따라 분해신호(N-degron)로 작용하고, N-말단 분해 신호 수용체(N-recognin)가 이를 인식해 분해를 매개하는 단백질 조절경로이다.
□ 연구팀은 이번에 비정상적인 스테로이드 수용체 보조 활성화제-1(SRC-1)를 분해하는 ‘단백질 분해 표적 키메라(PROTAC, proteolysis targeting chimera)’를 합성했다.이 화합물이 N-말단 분해 경로를 통해 세포 내 비정상적인 스테로이드 수용체 보조 활성화제-1(SRC-1)의 분해만을 유도함을 확인했다.
□ 생물체의 세포질 내에 존재하는 상당수의 단백질이 N-말단 경로에 의해 분해되기 때문에 연구팀이 개발한 N-말단 기반의 ‘단백질 분해 표적 키메라(PROTAC)‘을 이용하면 세포의 유형에 관계없이 단백질을 효과적으로 분해할 수 있음도 발견했다. 또한, 암 세포의 전이 활성(침윤과 이동)도 억제하는 것을 확인했다.
□ 이 연구는 과학기술정보통신부와 보건복지부가 주관하는 인공지능 신약개발 플랫폼 구축사업과 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
□ 논문의 제1저자인 이영주 박사는 ”암 전이에 매우 중요한 역할을 하는 SRC-1을 효과적으로 억제하는 화합물을 개발했다“며 ”특히, N-데그론을 이용한 단백질 분해 전략은 더 다양한 질환에 적용이 가능할 것으로 기대된다“고 말했다.
□ 교신저자인 임현석 교수는 “이 기술을 이용하면 기존의 신약개발 방법으로는 접근할 수 없었던 치매, 암 등 난치성 질환 관련 단백질을 약물 표적으로 이용할 수 있다”며 “이는 현재는 존재하지 않는 질병의 치료제 개발도 앞당길 수 있을 것으로 기대된다”고 말했다.
□ 연구 결과 개요
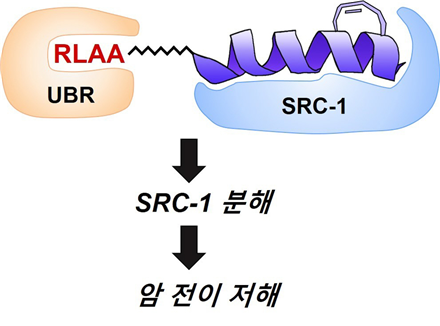
그림설명) 합성된 RLAA~ 화합물. 왼쪽 RLAA 는 아미노산이고, UBR box에 붙는 리간드이다. 오른쪽 보라색으로 된 부분은 SRC-1 단백질에 붙는 리간드이다. 이 둘을 연결한 화합물은 SRC-1 을 단백질 분해해 주는 UBR 근처로 가져오게 되고, 거리가 가까워짐에 따라 SRC-1 을 UBR이 자신의 타겟으로 인식하여 분해한다. 이러한 SRC-1의 분해는 암 전이와 발생을 억제한다. (사진 = 포스텍)
