인간화 생쥐모델
- 줄기세포치료제의 체내 면역원성 평가를 위한 인간화 생쥐 모델의 활용과 전략
이지윤 수석연구원
차의과학대학교 분당차병원 (leejiyoon@cha.ac.kr)
인간화 생쥐모델은 생쥐의 골수
안에 있는 조혈모세포의 기능을 방사선 조사나 화학약제 (busulfan)등을 이용하여 부분적으로 제거하고
난 후 인간의 조혈생성이 가능한 조혈모 줄기세포를 생쥐 몸 안에 주입해 생착시킴으로 인간의 면역세포가 생쥐의 몸 안에서 재건된 모델을 말한다.(1) 인간화 생쥐의 혈액은 생쥐혈액이 아닌 인간혈액으로 바뀌어진 상태이기 때문에 인간면역체계에
따른 여러 세포치료제의 면역거부반응이나 개발된 항암제의 치료효율을 생체 내에서 평가하기 좋은 플랫폼으로 인식된다.
또한, 인간 유래의 유전자, 세포, 크게는 조직 등이 오랜 기간 동안 생쥐의 환경 (niche)과 공존하고
있는 모델로도 인식된다. 적어도 HLA를 표현하는 인간의
세포치료제가 인간화 생쥐의 재건된 면역세포인 CD3 T 세포에 의해 어떠한 면역거부반응정도를 표현하는지
조사할 수 있기 때문에 줄기세포유래 세포치료제의 면역반응을 가장 친밀하고 정확하게 연결 지어 체내에서 분석 가능케 하는 유용한 동물모델이라 할
수 있겠다.(2)(3) 본 글에서는 인간화 생쥐모델의 확립과정과 기술전략, 이 모델을 이용한 연구들에 대해서 간단히 알아보고자 한다.
1> 인간화 생쥐모델의 확립
강한 면역원성을
보유한 생쥐의 경우 (Immune competent mouse)는 외부침입자가 생겼을 때 이를 탐식, 살해하는 등의 강한 면역거부반응을 보이며 외부항원으로부터 숙주의 세포들을 보호하게 된다. 인간의 조혈모세포를 이러한 외부 침입자로 여겨 안정된 생착을 방해할 가능성을 배제하기 위해 보통 인간화 생쥐모델은
면역결핍 혹은 부전 생쥐의 활용이 주를 이룬다. 미국 Jackson
Lab 의 (L,D.Shultz개발) NOD/LtSz-scid
IL2rϒ-/- 생쥐와 일본 Central Institute for
Experimental Animlas, CIEA 사의 (Mamoru Ito 개발) NOD/Shi-scidIl2rϒ-/- 생쥐의 활용이 대표적이다.(4)(5) 이들 생쥐는 NK세포의 발달과 활성을
촉진하는 사이토카인인 IL-2 의 수용체 일부가 knock-out 되어
있기 때문에 기존의 림프구계 세포인 T 세포와 B세포가 인간
조혈모세포를 공격하는 것을 선 차단함과 동시에 생쥐 NK세포의 선천적 공격으로부터도 추가적으로 면역반응을
회피해 무사히 인간 조혈모세포가 생쥐의 골수까지 귀소(homing)하도록 돕는 유전적 시스템을 보유하여
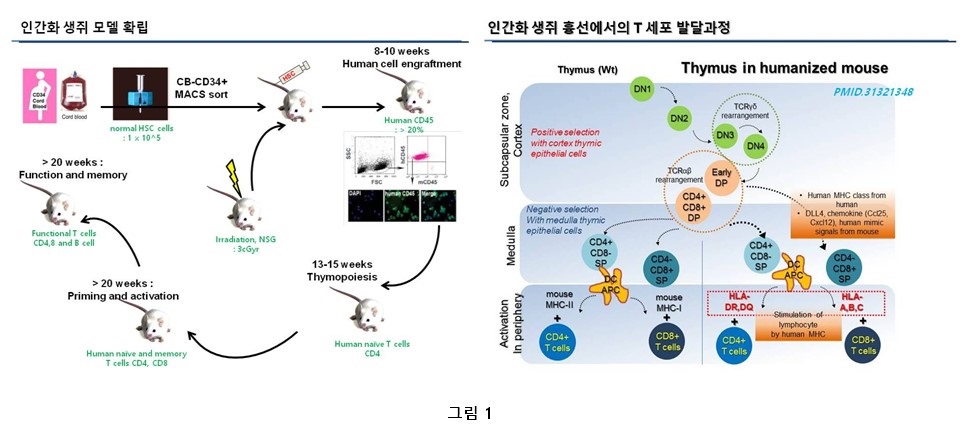
인간화의 효율을 높일 수 있는 생쥐라 할 수 있다. 인간의 혈액생성을 가능케 하는 제대혈 유래 조혈모세포 (CD34+ 세포)를 MACS
sorting 하여 꼬리정맥 주사 후 18시간 이내 골수 내 인간 혈액세포의 귀소 정도를
확인하고, 8주차에 적어도 15% 이상의 빈도로 인간혈액세포 (CD45+ 세포)를 보유한 생쥐를 인간화 확립된 모델이라 정의할
수 있겠다. (그림1 왼쪽참조)
조혈모세포유래 CD45 혈액세포는
골수구계와 림프구계의 모든 세포를 생산하지만, 인간화 생쥐모델 내에서의 성숙하고 활성화된 CD3 세포를 생산하는 것은 인간흉선에서의 HLA-II 발현 상피세포가
림프구계 세포 발달과 교육에 큰 역할을 담당하기 때문에 생쥐의 흉선세포만으로는 인간 T세포의 성숙이
골수구계 세포의 생성에 비해 어렵다는 난제가 있다. 이를 극복하기 위해 인간 태아의 조직을 이식하는 BLT (bone marrow, liver, thymus) 법이 상당부분 문제점을 해결해 주고 있는 실정이다.(6)(7) 13-15주째 thymopoiesis (흉선세포가 T세포로 성숙하는 과정)가 일어나며 생성된 인간의 림프구계 세포들은 20주 이상이 되면 림프구계 세포들의 활성을 기대할 수 있다. (8)
그러나, 이러한 이론을 바탕으로 개발된 혁신적인 BLT이식법도
인간태아조직의 획득이 용이하지 않다라는 현실적인 난점과 다양한 human leukocyte antigen
(HLA) 발현을 표현하는 세포부재로부터 오는 thymopoiesis의 미성숙 발달과정의
가능성이 여전히 존재한다. (그림 1 오른쪽 참조) 따라서 줄기세포 유래 분화 세포치료제에 따른 면역거부 반응 등의 이슈를 해결할 인간화 생쥐모델에서의 원천적
기술방법에 대한 연구는 여전히 진행 중이며, 인간의 사이토카인 분비를 촉진하는 유전자 조작 생쥐 생산과(9) 같은 진보된 기술력은 날로 발전하고 있는 중이다.
2> 인간화 생쥐모델이용 림프구계 세포의 활성유도 전략
재생의학을 포함한 의생명과학
분야에서의 인간화 생쥐모델 활용 요구는 지속적으로 상승세를 보인다. 특히, 세포치료 효능을 검증하기 위한 목적으로는 인간화 생쥐모델이 상당부분 해결책을 제시하였지만, 조혈모세포의 생착만으로 인간 T 세포 활성에 따른 면역반응을 제대로
보이기에 많은 부분 개선점이 여전히 필요하다.(10)(11) 본 연구실은 앞서 말한
대로 기술력 개발에 있어서 제한점을 극복하고, 인간화 생쥐의 안정적 림프구계 세포재건을 위한 대체방안으로
인간의 분화세포를 직접 주입하는 방법을 시도, 일부 thymopoiesis의 유도에 성공하였지만(3)
여전히 T세포의 활성에는
미온적 결과를 보였다. 그러나 이러한 시도를 바탕으로 최근 다양한 인간의 HLA 타입을 공유, 인지 가능케 하는 성인의 단핵구 세포들을 이용하여
세포들의 pooling lysate를 주사하는 방법을 개발, HLA 인지와
인간세포에 대한 세포활성을 유도하는데 성공한 바 있다. 향후 이와 같은 방법이 림프구계 세포재건에 있어서
상당히 좋은 효율을 보일 것이라 기대한다. (그림
2 참조)
3>
HLA I, II 를 제거한 줄기세포주 유래
분화세포의 인간화 생쥐모델에서의 면역원성 검증
재생의학을 타깃으로 하는 줄기세포주의 경우, 면역거부
등의 이슈를 해결하기 위해 인간 HLA-I (B2M-/-)과 II
(Ciita-/-) class를 유전적으로 제거한 줄기세포주의 활용이 부각되고 있다. 이들
세포주를 이용한 리니지 분화세포의 장기 생착 정도와 면역적합원성을 해결하기 위해 사용되는 인간화 생쥐모델은 가장 진보된 모델 중 하나인 SGM (SCF, GM-CSF, IL-3 사이토카인발현) 생쥐와(9) Rag1tm1MomIl2rgtm1Wjl/SzJ
(NRG) 생쥐 (Jackson Lab), NOD/LtSz-scid IL2rϒ-/- 생쥐 등이(4) 여전히 활발히 사용되고 있으며, 이들 인간화 생쥐모델은 줄기세포 유래 리니지 분화세포치료제의 면역적합성에 대한 전임상 검증을 완료하는데 중요한 생체 내 플랫폼으로 활용되고 있다.(3)(12)(13) 줄기세포치료제를 산업화하는데 있어서 지목되는 가장 큰 이슈 중 하나인
면역적합성에 대한 문제점을 해결하기 위해 HLA 동형접합의 저면역원성 세포주나 universal 개념의 세포주 개발이 시급한 시점이며, 이들 리니지
분화 세포치료제에 대한 전임상 단계에서 체내 검증이 인간화 생쥐모델을 이용하여 지속적으로 이루어질 것은 자명하다.
4>
결론
Reference
1. Shultz
LD, Ishikawa F, Greiner DL. Humanized mice in translational biomedical
research. Nat Rev Immunol. 2007; 7:118-130
2. Allen
TM, Brehm MA, Bridges S. et al. Humanized immune system mouse models: progress,
challenges and opportunities. Nat Immunol. 2019;20:770-774
3. Lee
JE, Lee JY, Park CH. et al. Cryopreserved human oocytes and cord blood cells
can produce somatic cell nuclear transfer-derived pluripotent stem cells with a
homozygous HLA type. Stem Cell Reports 2020;15:171-184
4. Shultz
LD, Lyons BL, Burzenski LM. et al Human lymphoid and myeloid cell development
in NOD/LtSz-scid IL2R gamma null mice engrafted with mobilized human
hemopoietic stem cells. J Immunol 2005;174:6477-6489
5. Ito
M, Hiramatsu H, Kobayashi K. et al. NOD/SCID/gamma(c)(null) mouse: an excellent
recipient mouse model for engraftment of human cells. Blood 2002;100:3175-3182
6. McCune
JM, Namikawa R, Kaneshima H. et al The SCID-hu mouse: Murine model for the
analysis of human hematolymphoid differentiation and function. Science 1988;241:1632-
1639
7. Smith
DJ, Lin LJ, Moon H. et al. Propagating humanized blt mice for the study of
human immunology and immunotherapy. Stem Cells Dev 2016;25:1863-1873
8. Bruno
L, Fehling HJ, von Boehmer H. The alpha beta T cell receptor can replace the
gamma delta receptor in the development of gamma delta lineage cells. Immunity 1996;5:343-352.
9. Eva B,Walter
T B, Kathy
M,Marcus
D.Development of human CD4+FoxP3+
regulatory T cells in human stem cell factor-, granulocyte-macrophage
colony-stimulating factor-, and interleukin-3-expressing NOD-SCID IL2Rγ(null)
humanized mice. Blood 2011;117:3076-3086.
10. Traggiai
E., Chicha L., Mazzucchelli L. et al. Development of a human adaptive immune
system in cord blood cell-transplanted mice. Science 2004;304:107-107.
11. Kooreman NG, Patricia EA, Jonathan PS. et al. Alloimmune
responses of humanized mice to human pluripotent stem cell therapeutics. 2017;20:1978-1990.
12. Tobias D, Xiaomeng H, Alessia G. et al. Hypoimmunogenic derivatives of induced
pluripotent stem cells evade immune rejection in fully immunocompetent
allogeneic recipients. Nat Biotechnol 20149;37: 252-258.
13. Huaigeng X,Bo W,Miyuki O. et al. Targeted
Disruption of HLA Genes via CRISPR-Cas9 Generates iPSCs with Enhanced Immune
Compatibility. Cell stem cell 2019;24:566-578.
