표적 단백질 분해 기술
(Target Protein
Degradation Technology, TPD)
㈜업테라 연구개발총괄이사
류수희 (shryu@uppthera.com)
서론
근접 유도 약리학(Proximity inducing pharmacology)은 현재 학계나 제약 산업에서 뜨거운 관심을 받고 있는
치료 패러다임이다. 그 치료 양식(Therapeutic
modality)의 핵심은 단백질과 같은 거대 분자 간의 상호 근접성을 유도하는 것이다. 역학적으로는
저분자 화합물 혹은 약물에 의해서 자연적으로 일어나지 않는 서로 다른 단백질들의 상호작용을 유도하는 약물 양식이며, 그 중 개발 속도가 빠르고 가장 임상적으로 검증이 많이 되고 있는 표적 단백질 분해 기술(TPD)이 특히 주목을 받고 있다.
표적
단백질 분해 기술에서 저분자 분해제(small molecule degrader)는 E3 유비퀴틴 리가제와 관심 단백질(Protein of Interest)사이의
분자적 근접성을 유도하고, 나아가 관심 단백질의 폴리 유비퀴틴화 및 프로테아좀 분해로 이어진다 [그림 1]. 저분자 분해제는 일반적으로 이종이기능성 분해제(heterobifunctional degrader)와 단일가 분자 접착제(monovalent
molecular glue)로 분류되며, 이종이기능성 분해제의 경우 PROTAC(Proteolysis Targeting Chimera)으로 불린다.
그림1. 저분자 분해제의 단백질 분해 유도 기작.
(A) 분자 접착제에 의한 단백질 분해 유도 기작.
(B) PROTAC에 의한 단백질 분해 유도 기작
(Milka Kostic et al. Trends Pharmacol Sci. 2020 May;41(5):305-317)
그림 2. PROTAC 기술 개발 연표 (Miklos Bekes et al. Nat
Rev Drug Discov. 2022 Mar;21(3):181-200)
PROTAC의 연구 개발은 2001년 Sakamoto 연구 그룹에서 펩타이드 기반의 이종이기능성 물질이 관심 단백질을 의도적으로 E3 유비퀴틴 리가제로 근접 유도하여 타겟 단백질을 분해시킬 수 있다는 개념 증명 문헌으로부터 시작되었다. 2010년 중반에는 펩타이드 기반에서 벗어나 약물성이 현저히 개선된 저분자 기반의 분해제에 대한 연구 개발
보고가 활발히 이어졌고, 2019년 Arvinas 사를 시작으로
현재는 다수의 제약사에서 여러 파이프라인에 대한 임상 시험을 진행하고 있다 [그림 2].
그림
2의 PROTAC 기술 개발 연표를 보면, 저분자 분해제에 대한 연구개발이 활발히 진행된 지 10년이 되지
않았음에도 불구하고 2022년 현재 다수의 파이프라인이 임상 개발되고 있는 것을 볼 수 있다. 이것은 표적 단백질 분해 기술에 대한 학계와 제약사들의 큰 관심을 반영하고,
이러한 관심은 기존 저분자 저해제(Small molecule inhibitor) 대비 PROTAC으로 대표되는 표적 단백질 분해제가 가지는 명확한 장점이 있기 때문이다. PROTAC의 장점으로는 다음 내용들은 언급할 수 있다. 1) PROTAC은
관심 단백질의 분해를 주요 약물 기작으로 하는 이벤트 기반(event-driven) 치료제이기 때문에, 낮은 농도에서 원하는 약효를 기대할 수 있다. 2) 또한 약물이
세포 혹은 생체 내에서 재활용(recycling)됨으로 약물 사용을 줄일 수 있고, 그에 따라서 부작용을 최소화할 수 있다. 3) 관심 단백질을 분해함으로써
기존 저해제의 저항성을 극복할 수 있다. 4) 관심 단백질의 활성 부위만을 억제할 수 있는 기존 저해제
대비하여 단백질의 스캐폴드(scaffold) 기능까지 억제할 수 있어 차별적인 약효를 볼 수 있다. 5) 활성 부위를 표적하기 힘든 undruggable 단백질들 또한
약물의 타겟으로 접근 가능하다.
본 글에서는 표적 단백질 분해 기술을 활용한 PROTAC의
임상 파이프라인 현황을 정리하고, 임상 파이프라인들에서 보이는 특징들을 분석하고자 한다. 이런 분석을 통하여 각 제약사에서 PROTAC이라는 새로운 치료
양식을 어떤 관심 단백질을 대상으로 적용하고 임상 파이프라인을 개발하고 있는지 알 수 있고, 또한 현재의
PROTAC 기술과 임상 파이프라인 한계점을 파악할 수 있다. 나아가서
학계와 여러 제약사에서 PROTAC 기술을 앞으로 어떻게 발전시켜 나가고자 하는지 소개하고자 한다.
본론
- PROTAC 임상 개발 현황 및 특징 분석
그림 3. PROTAC 임상 물질 (Miklos Bekes et al. Nat Rev
Drug Discov. 2022 Mar;21(3):181-200)
여러 제약사의 PROTAC 임상 개발 현황은 그림 3과 같다. Arvinas 사의
ARV-110 및 ARV-471은 임상 2상을
진행중이며, Bristol Myers Squibb(BMS), Nurix Therapeutics, Kymera,
Dialectic Therapeutics, Foghorn Therapeutics 등에서 각 파이프라인들에 대해서 임상 1상을 진행중이다.
임상 파이프라인들의
특징을 관심 단백질, 적응증, E3 유비퀴틴 리가제, 약물 투여 경로(Route of administration, ROA) 측면에서
분석할 수 있다. 현재 임상 파이프라인의 주요 관심 단백질은 생물학적 및 생화학적으로 매우 잘 알려져
있고, 각 적응증에서 임상적으로 검증된 타겟이라는 것을 알 수 있다.
그 대표적인 예로 전립선암에서 AR 단백질이나 유방암에서 ER 단백질이 있고, 각 관심 단백질의 주요 파이프라인인 ARV-110 및 ARV-471의 임상 결과 보고에 따르면 언급된 기술의
장점을 반영하듯 유효한 약효가 있음이 검증되고 있다. 뿐만 아니라 독성 문제에 있어서도 기존 저해제
대비 월등함이 입증되고 있다.
적응증 측면에서는
대다수의 임상이 항암을 주요 적응증으로 선택하고 있음을 확인할 수 있다. 항암 분야를 제외하고 PROTAC 약물로 접근하고 있는 적응증은 면역 염증성 질환이 유일하다. 대표
개발사와 약물은 Nurix Therapeutics 사의 BTK
degrader(NX-5948)와 Kymera 사의 IRAK4
degrader(KT-474)이다. BTK(Bruton’s Tyrosine kinase)의
경우 염증성 질환 및 항암으로 잘 알려진 관심 단백질이고, 표적 단백질 분해 기술로 1세대 BTK 저해제의 대표적 내성 돌연변이 C481S를 극복할 수 있다는 점에서 학계와 제약사에서 많은 관심을 가지는 타겟이다. 이에 반해 IRAK4(Interleukin-1 receptor
associated kinase 4)의 경우 염증성 질환 및 B 세포 림프종에서 생물학적
기능이 잘 알려져 있지만,
PROTAC 파이프라인에서 단 하나를 제외하면 모두 CRBN(Cereblon)이
E3 유비퀴틴 리가제로 활용되고 있다. 주목할 만한 예외는
VHL(Von Hippel-Lindau) ligand를 유일하게 활용하고 있는 Dialectic Therapeutics 사의 DT2216이다. 그림 3에서 확인되는 분해제(degrader)는
합성 의약품으로 약물 투여 경로는 경구로 하는 경우가 많다. 경구 투여 약물의 경우 모두 CRBN을 E3 유비퀴틴 리가제로 활용하고 있고, 정맥 투여 약물은 VHL이 활용되고 있다.
- 임상 파이프라인에서 보이는 한계점
대다수의 임상 파이프라인에서 특정 E3 유비퀴틴 리가제가 적극적으로 활용되고 있다. 이는 E3 유비퀴틴 리가제 리간드(ligand)를 활용한 PROTAC 문헌들에서 보고된 특징을 종합하여 설명이 가능하다.
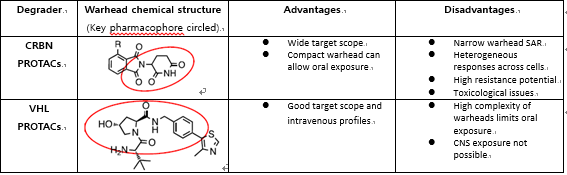
다수의 임상 파이프라인
적응증에서 약물의 경구 투여가 선호되고 그에 따라서 표 1에서 보듯이 경구 노출(oral exposure)이 가능한 리간드가 있는 CRBN이 E3 유비퀴틴 리가제로 적극 활용되고 있다. CRBN 리간드로 활용되고
있는 IMiDs(Immunomodulatory Drugs) 계열 약물(Thalidomide,
Pomalidomide, Lenalidomide)은 다발성 골수종 등의 적응증에서 치료제로 임상에서 사용되고 있다. IMiDs를 포함한 약제 요법에 대해서 다발성 골수종 환자의 대다수는 3년에서
5년 내 약물에 대한 내성이 발생한다고 알려져 있고, 발생
내성의 약 20%에서 30%는 CRBN 단백질의 돌연변이 혹은 CRBN 단백질 발현 감소로 IMiDs 약물이 효력을 나타내기 어렵기 때문으로 보고된다. 또한 CRBN은 정상 세포의 피트니스(fitness)에 중요하지 않는 비필수(non-essential) 유전자로 알려져 있어 돌연변이 발생에 취약하다고 추측되어 왔다.
임상적으로 PROTAC 파이프라인에 대한 내성 혹은 저항성에 대한 보고는 없다. 향후
임상에서 발생될 수 있는 약제 내성에 대한 기초적인 연구 기반을 제공하고자 2019년 AbbVie사에서 시험관 내 시험(in vitro) 조건에서 PROTAC 저항성에 관한 연구를 수행하였다. 문헌에 따르면 E3 유비퀴틴 리가제 복합체의 핵심 요소인 CRBN의 발현 감소가
ARV-885 저항성의 주요 메커니즘으로 확인된다 (lu Zhang
et al. Mol Cancer Ther. 2019 Jul;18(7):1302-1311).
- E3 유비퀴틴 리가제 연구 및 신규 리간드 개발의 필요성
현재 임상에서
사용되고 있는 E3 유비퀴틴 리가제와 그 리간드의 단점들(예를
들어, 경구 노출 여부, 약물 저항성 등)이 명확히 보고되고 있다. 그에 따라서 관련 학계 및 제약사에서는
차세대 E3 유비퀴틴 리가제와 리간드 발굴을 위해서 연구를 수행하고 있고, 관련 보고들이 지속적으로 나오고 있다. E3 유비퀴틴 리가제
연구와 그 리간드의 개발은 다음과 같이 크게 3 단계로 나누어 볼 수 있다.
1. 다른 특징을 가진 E3 유비퀴틴 리가제의 선별
현재 학계와 제약
업계에서는 개발하고자 하는 약물의 관심 단백질과 적응증을 고려하여 E3 유비퀴틴 리가제의 조직별 발현
패턴, 질환과 정상 조직 간의 차별적 발현 패턴 등을 확인하는 연구 과정을 선행하고자 노력한다. Human Protein Atlas의 단백질 발현 데이터를 마이닝(Data
mining)하면 임상적 혹은 문헌적으로 PROTAC에 많이 적용하고 있는 E3 유비퀴틴 리가제(CRBN, MDM2, IAP 등)는 생체 내 어느 조직에서나 잘 발현되는 것을 확인할 수 있고, 나아가서
skeletal muscle 특이적 E3 유비퀴틴 리가제
KLHL40과 KLHL41을 선별할 수 있다 [그림 4].
2. 선택된 E3 유비퀴틴
리가제의 기능 검증
조직
및 질환에 특이적인 E3 유비퀴틴 리가제를 선별하였다면, 리간드
발굴 작업전에 기능을 검증하는 단계가 필요하다. 이는 기존 연구 문헌을 기반으로 수행할 수 있지만 생체내에는
약 ~600종 이상의 E3 유비퀴틴 리가제가 보고되었고, 대다수의 리가제는 문헌적인 연구 결과가 부재한 한계점이 있다.
이를
극복하기 위해 최근 4Th Annual TPD 학회에서 Amgen사의 Ryan Potts 그룹이 실험적인 검증 방법을 고안하여
발표하였다. 실험법은 E3 유비퀴틴 리가제와 관심 단백질에
서로 다른 꼬리표(Tag)를 표지하여 발현하는 것으로부터 시작한다. 그
후 각각 꼬리표들(Tags)에 결합하여 두 재조합 단백질(E3 유비퀴틴
리가제와 관심 단백질)의 이량체화(dimerization)를
유도하는 화합물을 처리하여, 최종적으로 관심 단백질의 분해 여부와 효율을 확인하면 된다 [그림 5]. 본 실험법은 활성이 보고되지 않은 E3 유비퀴틴 리가제의 기능을 검증하고 표적 단백질 분해 기술에 적용 가능한지 평가할 수 있다.
그림 5. E3 유비퀴틴 리가제의 실험적 기능 검증법 (4Th Annual TPD 학회)
3. 리간드 선별
최종적으로
검증된 E3 유비퀴틴 리가제에 대한 리간드 선별은 다양한 방식이 적용 가능하다. 예를 들면 virtual screen, DEL(DNA-encoded
library), Fragment based screen, HTS, covalent probe screen 등이다. 여러 방식 중 가장 가시적인 성과가 많이 보고되는 선별법은 covalent
probe screen이다. RNF114, RNF4, DCAF11, DCAF16 등 다양한
E3 유비퀴틴 리가제에 대해서 공유 리간드(covalent ligand)가
새롭게 발굴되었다 [그림6]. PROTAC의 리간드 부분으로
활용되었을 때, 관심 단백질의 최대 분해율(Dmax), 반수
최대 분해 농도(DC50)를 하기 그림 6에서 확인할 수
있다.
그림 6. 공유 리간드 PROTAC
본 글에서는 현재 임상 진행 중인 PROTAC 파이프라인들을 분석하였으며, 그 중 핵심적인 특징으로는 다음과 같이 크게 2가지를 말할 수 있다.
첫번째로는 국한된 적응증(항암)을 언급할 수 있다. 이는 임상적으로 검증되지 않은 치료 양식에 대한 우려로 인해 항암 분야 국한되어 연구 개발이 시작되었다고 이해할 수 있다. 현재는 염증 질환을 필두로 하여 조금씩 다변화되고 있는 상황이며, 비임상 수준에서는 알츠하이머 질환과 같은 퇴행성 뇌질환을 대상으로 한 약물들이 연구개발 중에 있는 것으로 확인된다.
두번째 특징으로는
집중된 E3 유비퀴틴 리가제(CRBN) 혹은 그 리간드를
사용하고 있다는 점을 언급할 수 있다. 이런 집중 현상은 리간드 풀(ligand
pool)에서 한계가 있기 때문으로 생각된다. 따라서 학계를 넘어 제약 업계에서는 새로운 E3 유비퀴틴 리가제에 대한 리간드 개발에 열을 올리고 있다. 학계에서
문헌적으로 성과가 가장 많이 보고된 연구는 단연 시스테인 반응성(cysteine-reactive) 공유
리간드(covalent ligand) 발굴와 그 PROTAC 적용에
관한 내용들이다[그림 6]. 제약 업계에서는 2021년 Vividion 사에서 공유 E3 유비퀴틴 리간드를 활용한 PROTAC 연구를 TPD 관련 학회에서 발표하였다. 다양한 세포주 실험에서 CRBN 또는 VHL 리간드 기반 PROTAC
물질 대비 시스테인 반응성 공유 리간드 기반 PROTAC 화합물(VVD-9546)의 효능이 우월하다는 것을 입증하였다. 인간 단백질
전체(proteome)에서 리간드 가능(ligand-able)한
시스테인을 가진 단백질은 약 20% 정도라고 알려져 있다. 그러므로
더 넓은 범위의 프로테옴(proteome)에 적용하려면 시스테인 반응성을 넘어서는 차세대 공유 프로브(covalent probe)의 개발이 필요하고 할 수 있다. 최근에는
라이신/타이로신 반응성 공유 프로브 (lysine/tyrosine
reactive covalent probe)들이 보고되고 있어 향후는 관련 probe를
이용하여 다양한 E3 유비퀴틴 리가제의 리간드가 보고될 것으로 기대된다 (HS Hahm et al. Nat Chem Biol. 2020 Feb;16(2):150-159). 나아가서 새롭게
개발되는 다양한 리간드를 적극 활용하여 현재 임상 물질을 뛰어넘는 프로파일을 가지는 임상 물질이 개발될 수 있기를 고대한다.
